 Last updated : May.5.2001
|
| ダイビングって水中でのレクリエーションスポーツ(?)ですよね。 陸上のスポーツと大きく違うのは、常に圧力(水圧)がかかっている環境で、空気を補充しながら楽しむってこと。 だからその空気と圧力が及ぼす影響を知ったうえで楽しまないと、ちょいと危険なのです。 空気は一種の混合気体で、78%の窒素、21%の酸素、そして1%の稀ガスから構成されています。 これはどんな状態においても、この割合は一緒だと考えてくださいね。 私たちダイバーはこの『空気』を背負って海に潜るのです。 さて、 『潜る』ということは、どんくらいの圧力の影響を受けるんでしょ? それがボイルの法則でわかっちゃうのら。 |
|
|
|
気体の分圧が高くなるだけその気体の影響も大きくなるっていうこと、わかるかな? |
|
|
| 簡単にばぁぁぁぁっと説明してきたけど、なんとなくわかってもらえたかなぁ? 舐めたら怖いスポーツだけど、正しい知識を持ったうえで、そしてレクリエーション・ダイブの範囲であればそんなに危険なスポーツではないんです。 この夏、あなたもいかが??(爆)(^-^)/ |
Copyrhigh(c)1997-2007 Aqua Planet. All
right reserverd. |
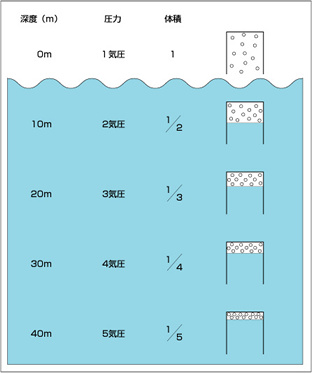 空気は圧力をかけることによって圧縮することが出来ます。一定の体積の空気を圧縮していくと2つのことが起きます。
空気は圧力をかけることによって圧縮することが出来ます。一定の体積の空気を圧縮していくと2つのことが起きます。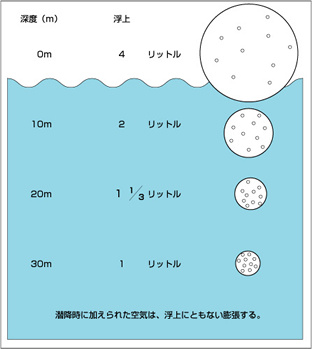 つねに水面のときの体積と同じ体積を保つということは…
つねに水面のときの体積と同じ体積を保つということは…